|
C.Mascolini, Daliento, C.Del Plato (*) - I.Ionita (**)
(*) Istituto Alfano I - (**) University of Galati
Termodinamica
Sommario
La termodinamica è lo studio del rapporto tra il calore, il lavoro ed il sistema che analizza i processi dell’energia.
I processi dell’energia che trasformano l’energia del calore da fonti disponibili, come i carburanti chimici nel lavoro meccanico, sono l’elemento fondamentale di questa scienza.
La termodinamica consiste di un numero di metodi analitici e teorici che possono essere applicati alle macchine per la conversione energetica.
Prima Legge della Termodinamica
La prima legge della termodinamica è l’applicazione del principio di conservazione dell’energia nell’emissione di calore nel processo termodinamico:
|
|
|
Cambio dell’ energia interna |
Calore aggiunto al sistema |
Lavoro fatto dal sistema |
La prima legge utilizza i concetti chiave dell’energia interna, il calore e il sistema. È usata largamente nei principi dei motori a scoppio.
È tipico nei testi di chimica scrivere la prima legge come ? U = Q + W
è la stessa legge, inerente l’espressione termodinamica della conservazione del principio dell’energia. È solamente che W è definito come il lavoro fatto sul sistema invece del lavoro fatto dal sistema.
Nel contesto della fisica, lo scenario comune è quello di aggiungere calore al volume del gas e usare l’espansione di quel gas per ottenere lavoro, come la spinta di un pistone in un motore a combustione interna. Nel contesto delle reazioni e dei processi chimici è più comune trovare delle situazioni dove il lavoro viene fatto sul sistema e non da esso.
Entalpia
Quattro quantità chiamate (potenziali termodinamici) sono utili nella termodinamica chimica delle reazioni e nei processi non ciclici. Essi sono energia interna, l’entalpia, la libera energia di Helmholtz e la libera energia Gibbs. L’entalpia viene definita da:
H = U + PV
Dove P e V sono la pressione ed il volume e U è l’energia interna. L’entalpia è quindi uno stato variabile misurabile, dal momento in cui è definita in termini di tre altri stati definibili variabili. È qualcosa di parallelo alla prima legge della termodinamica per un sistema di pressione costante
Q = ΔU + PΔV dato che in questo caso Q=ΔH
È una quantità utile per rilevare le reazioni chimiche.
Se come risultato di una reazione esotermica, l’energia viene rilasciata ad un sistema, essa deve rivelarsi in forma misurabile nei termini variabili di uno stato. Un incremento dell’entalpia H=U+PV potrebbe essere associato ad un incremento dell’energia interna che potrebbe essere misurata dal calorimetro o dal lavoro fatto dal sistema o una combinazione dei due.
L’energia interna U potrebbe essere considerata come l’energia richiesta per creare un sistema nell’assenza di cambiamenti di temperatura o di volume. Ma se il processo cambia il volume, come in una reazione chimica che trasforma un prodotto in gas, allora il lavoro deve essere fatto per produrre il cambiamento del volume. Per un processo della pressione costante il lavoro che si deve fare per produrre un cambiamento di volume ?V è P?V. Allora il termine PV può essere interpretato come il lavoro da fare per creare spazio per il sistema se si presume di iniziare a volume 0.
Sistema di lavoro
Quando il lavoro è fatto da un sistema termodinamico, di solito è un gas che sta facendo il lavoro. Il lavoro fatto da un gas ad una pressione costante è:
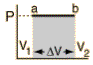 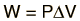
La retta da A a B rappresenta un espansione di un gas ad una pressione costante. Il lavoro fatto è l’area sotto la curva
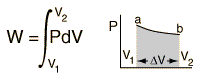
Per una pressione non costante, il lavoro può essere visualizzato come l’area sotto la curva del volume della pressione che rappresenta lo sviluppo del processo. L’espressione più comune per il lavoro fatto è:
L’integrale dà l’esatta area sotto la curva che è uguale al lavoro.
Il lavoro fatto da un sistema diminuisce l’energia interna di un sistema, come indicato nella prima legge della termodinamica. Il lavoro del sistema è uno dei punti fondamentali sul dibattito sui motori a scoppio.
Seconda Legge della Termodinamica
La seconda legge della termodinamica è un principio generale che pone dei limiti alla direzione del trasferimento del calore e l’efficienza ottenibile dai motori a scoppio. Nel fare ciò essa va al di là dei limiti imposti dalla prima legge della termodinamica.
L’efficienza massima che può essere ottenuta è l’efficienza Carnet.
Seconda Legge: Heat Engines
Seconda legge di termodinamica: è impossibile estrarre una quantità di calore QH da una riserva ed usarla tutta per effettuare un lavoro W. Una quantità di calore si esaurisce in una riserva più fredda. Questo preclude un motore a scoppio perfetto.
Questo è qualche volta chiamata la prima forma della seconda legge ed è riferita come l’affermazione della seconda legge di Kelvin Planck
Seconda Legge: Entropia
Seconda legge di termodinamica: in ogni processo ciclico l’entropia aumenterà o rimarrà uguale:
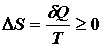
Entropia: uno stato variabile il cui cambiamento è definito da un processo reversibile a T dove Q è il calore assorbito
Entropia: una misura di quantità di energia che non è disponibile per il lavoro
Entropia: una misura del disordine di un sistema
Entropia: una misura della molteplicità di un sistema.
Dal momento che l’entropia dà informazioni sull’evoluzione di un sistema isolato nel tempo, esso ci dà la direzione sull’asse del tempo. Se due diverse immagini di un sistema mostrano uno stato di disturbo questo potrebbe implicare che questo stato abbia tempi più lunghi. Per un sistema isolato, il corso naturale degli eventi conduce il sistema ad uno stato di maggiore disordine (più alta entropia)
Processi di un Motore a Scoppio
I processi di un motore a scoppio sono mostrati su un diagramma P V se la pressione, il volume e la temperatura sono costanti un processo utile è il processo adiabatico dove nessun calore entra o esce dal sistema.
Il Motore Diesel
Il motore Diesel differisce da quello a benzina a ciclo otto perché usa una maggiore compressione del carburante per incendiare la miscela invece di usare una candela. (accensione a compressione piuttosto che a scintilla).
Nel motore Diesel l’aria è compressa adiabaticamente con un rapporto di compressione tra 15 e 20. Questa compressione aumenta la temperatura fino all’accensione del carburante iniettato non appena l’aria è compressa.
Il ciclo ideale dell’aria è modellato come una compressione adiabatica reversibile seguita da un processo di combustione di pressione costante, poi un’espansione adiabatica come uno scoppio ed uno scarico iso-volumetrico. Un nuovo flusso di aria entra alla fine dello scoppio come indicato dai processi a-e-a sul diagramma.Dal momento in cui la compressione e lo scoppio di questo ciclo idealizzato sono adiabatici, l’efficienza può essere calcolata dalla pressione costante e dai processi di volume costanti. Le energie in entrata ed in uscita e l’efficienza possono essere calcolate dalle specifiche temperature:
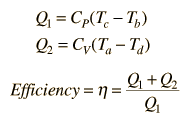
È conveniente esprimere questa efficienza in termini di rapporto di compressione rC = V1/V2 ed il rapporto di espansione rE = V1/V3. L’efficienza può essere scritta
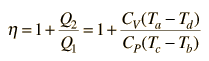
Ora usando la legge ideale dei gas PV= n R T e g= CP/CV,
questa può essere scritta
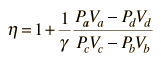
applicando Va = Vd = V1 e Pc=Pb dal diagramma
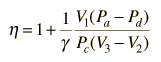
dividendo il numeratore e denominatore per V1Pc
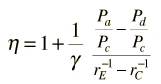
ora facendo uso della condizione adiabatica PVg= costante,
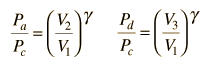
l’efficienza può essere scritta
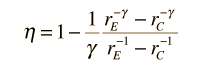
Il Motore Otto
cv – Volume Costante del Calore Specifico γ – Rapporto di Calore Specifico
p – Pressione T – Temperatura
V – Volume f – Rapporto Aria/Carburante
Q – Valore del Calore del Combustibile Cps – Cicli al Secondo
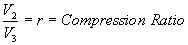
Forza di compressione: Combustione: Potenza
:
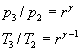 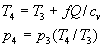 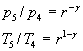
Lavoro per ciclo: 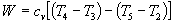
Potenza del Motore: 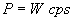
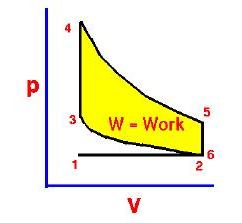
Ciclo ideale Otto
Nella figura mostriamo l’immagine della pressione rapportata al volume del gas attraverso un ciclo. Abbiamo sezionato il ciclo in sei stadi numerati basati sulle operazioni meccaniche del motore. Per il motore ideale a quattro tempi, l’aspirazione (1-2) e lo scarico (6-1) sono effettuati a temperatura costante e non contribuiscono a generare potenza da parte del motore. Durante il tempo della compressione (2-3) il lavoro viene fatto sulla benzina dal pistone. Partendo dalla considerazione che non entra calore nella benzina durante la compressione, noi veniamo a conoscenza delle relazioni tra il cambiamento di volume e il cambiamento di pressione e temperatura dalle nostre soluzioni inerenti l’equazione dell’entropia per un gas. Noi chiamiamo rapporto di volume l’inizio della compressione mentre alla fine della compressione parliamo di rapporto di compressione, r. Quindi
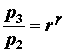 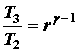
dove p è la pressione, T è la temperatura e Y è il rapporto di valori specifici. Durante il processo di combustione (3-4) il volume viene tenuto costante ed il calore disperso. Il cambiamento della temperatura è dato da
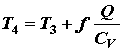
dove Q è il calore rilasciato per libbra di carburante che dipende dal carburante, f è il rapporto aria/carburante per combustione che dipende da notevoli fattori associati al disegno ed alla temperatura della camera di combustione e CV è il calore specifico a un volume costante. Dall’equazione di stato noi sappiamo che:
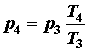
durante la fase di scoppio (4-5) il lavoro viene fatto dalla benzina sul pistone, il rapporto di espansione è lo stesso del rapporto di compressione e si possono usare le stesse relazioni utilizzate durante le fasi della compressione::
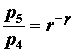
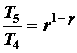
tra la fase 5 e la fase 6, il calore residuo viene trasferito intorno in modo che la temperatura e la pressione ritornano alle condizioni iniziali della fase 1 (o 2).
Durante il ciclo, il lavoro viene fatto dal pistone sulla benzina tra le fasi 2 e 3. Il lavoro viene fatto sul pistone dalla benzina nelle fasi 4 e 5. La differenza tra lavoro fatto dalla benzina e il lavoro fatto sulla benzina è mostrato in giallo ed è il lavoro prodotto dal ciclo. Possiamo calcolare il lavoro determinando l’area racchiusa dal ciclo sul diagramma p – V ma dal momento in cui i processi 2 – 3 e 4 – 5 sono curve, questo è un calcolo difficile. Possiamo anche valutare il lavoro W dalla differenza del calore nel gas meno il calore rifiutato dal gas. Conoscendo le temperature, questo è un calcolo più semplice
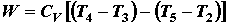
il lavoro che scandisce l’andamento del ciclo ( cicli per secondo cps) è uguale alla potenza P prodotta dal motore.
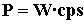
L’efficienza è::
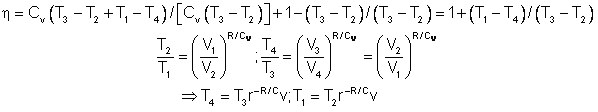
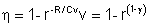
Links

http://hyperphysics.phy-astr.gsu.edu/hbase/heacon.html#heacon
http://www.grc.nasa.gov/WWW/K-12/airplane/ottoa.html
http://www.egr.msu.edu/~lira/supp/pg160expanded.pdf
http://www.tpub.com/content/engine/14037/css/14037_93.htm
http://www.engr.colostate.edu/~allan/thermo/page1/page1f.html
http://www.taftan.com/thermodynamics/
http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/heatengcon.html#c1
Inizio Pagina - Modulo Precedente
- Modulo Successivo
|






